
En el anterior post comentamos las hipótesis que Masaru Emoto tenía acerca de las habilidades del agua de formar cristales de hielo más bellos si se la sometía a música o sentimientos que fueran 'buenos' y bonitos. En definitiva, Emoto propugnaba que los pensamientos, oraciones y palabras dirigidas al agua eran responsables de la estructura particular que adquirían los cristales en su formación. ¿Qué hay de cierto en esas afirmaciones?
La cuestión principal es saber qué mecanismos influyen en la formación de hielo y qué factores físico-químicos pueden alterar su fisonomía. En este post trataremos muy por encima la formación de copos de nieve. Quién quiera saber más de este tema le recomiento el excelente review 'The Physics of snow crystals' de Kenneth G. Libbrecht, y la página personal del mismo autor, que pertenece al Laboratorio de Física 'Norman Bridge' en el Instituto Tecnológico de California (Caltech). Tiene unas bellísimas galerías de copos de nieve, y creo que conseguidos sin ponerle al agua ningún tipo de música relajante ni pegatinas amorosas (y además con agua destilada, nada de manantiales milagrosos).
La primera pregunta que debemos responder es cómo se forman los copos de nieve en la naturaleza. Como cuando estábamos en el colegio, diremos que todo empieza y termina en ese maravilloso Ciclo del Agua que todos conocemos bien. El vapor de agua contenido en la atmósfera puede llegar a condensarse en la superficie de microscópicas partículas (polvo, polen,...) creando minúsculas gotas de agua en suspensión que agrupadas darán lugar a las nubes que podemos ver. Esas pequeñas gotas de agua pueden llegar a estar a temperaturas muy bajas, a veces por debajo de la temperatura de congelación (gotas superenfriadas). Cuando una de estas gotas se congela y forma hielo, a su alrededor el vapor de agua del ambiente se va solidificando y agregando al núcleo de hielo inicial, haciendo crecer un copo de nieve.
Los cristales fabricados por Emoto no tienen ese origen. Las muestras de agua se depositaban en placas de Petri y se congelaban hasta que los cristales aparecían en la superficie de la misma, como la fina capa que se forma en fuentes y estanques en un frío día invernal. En ese caso, lo que se obtiene no es un copo único sino cientos de cristales diferentes en la superficie de la placa Petri. Cientos de cristales de los que, por supuesto, el Dr. Emoto sólo fotografió para su trabajo aquellos que le interesaban. La primera en la frente, como se dice.
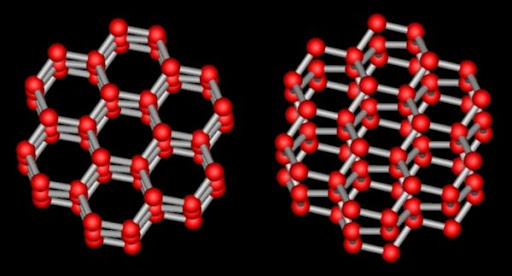
Según nuestra 'escala de belleza' (incluida la de Emoto por lo visto) un cristal es más hermoso cuanto más parecido sea a la visión tradicional de un copo de nieve: con simetría hexagonal y multitud de pequeñas bifurcaciones. Cuanto más complicada sea su forma, más bello nos parece, como algunas de la imágenes de arriba. Esa típica forma hexagonal proviene en última instancia de la geometría de las moléculas de agua y de la particular estructura cristalina que forman entre ellas. En condiciones ambientales como las que se pueden encontrar en la superficie terrestre, las moléculas de hielo se agrupan formando un enrejado que recuerda a un panal de abejas por sus casillas hexagonales, como el que vemos en la imagen lateral.
Vale, pero, ¿es cierto que existen factores externos que son capaces de cambiar la estructura cristalina del hielo? Pues sí, existen. Pero tranquilos, no os asustéis. Esos factores no son ni oraciones devotas, ni palabras de amor, ni pensamientos espirituales. Las propiedades que pueden cambiar la red cristalina del hielo son tan conocidas que preguntamos por ellas a menudo: la presión y la temperatura. En la figura siguiente observamos lo que en física y teoría de materiales se llama diagrama de fases del agua. Es una representación de las distintas fases por las que puede pasar el agua (pura, en este caso) cuando variamos las dos variables antes mencionadas:
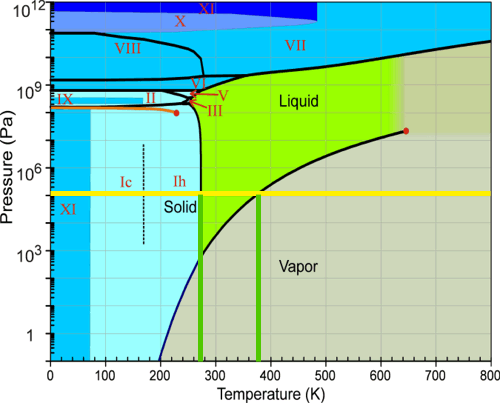
La línea amarilla representa la presión estándar atmosférica (1atm, 101300Pa). Las líneas verdes indican en que temperaturas el agua se congela (0ºC, 273K) o hierve (100ºC, 373K) a esa presión determinada. Fijémonos ahora en los números romanos de la gráfica, los de color rojo. Son las diferentes clases de hielo que podemos obtener. Tomemos como ejemplo nuestra presión atmosférica (línea amarilla) y vayamos al rango de temperaturas entre 160K (-113ºC) y 273K (0ºC). En esta zona, el hielo que obtendremos de la cristalización del agua es de tipo Ih, que tiene una red cristalina de geometría hexagonal. Por tanto, en la naturaleza, dónde la presión y temperatura son parecidas a las anteriores, los cristales de hielo que obtendremos serán de este tipo. Pero si bajamos más la temperatura (<160K) entramos en el reino del hielo-Ic, cuya estructura cristalina es cúbica, o el hielo XI que se ordena según una geometría ortorrómbica (este último es un grupo pseudohexagonal, por lo que podría formar cristales hexagonales).
Si en lugar de variar la temperatura aumentásemos la presión nos encontraríamos con grupos cúbicos (hielo-VII,X), tetragonales (hielo-III,XII)... Así hasta dieciséis tipos de hielo diferentes. Decir que aunque el grupo cristalino sea de un tipo en particular, los cristales macroscópicos que generan pueden tener geometrías distintas a la celda inicial, aunque siempre compatibles con ésta (algo parecido a montar piezas de Lego).
Pero estamos hablando de valores que, en general, no se alcanzan en la biosfera. Entonces, ¿los cristales de hielo deben tener la misma forma en las condiciones de presión y temperatura en las que solemos movernos? Pues tampoco. Ya hemos comentado que pueden formarse estructuras macroscópicas aparentemente diferentes de la celda cristalina. Y también la humedad del ambiente tiene algo que decir. El siguiente diagrama (Libbrecht) muestra los tipos de cristales que se obtienen cuando se trabaja en un rango de temperaturas y humedades no tan extremas como las de antes.
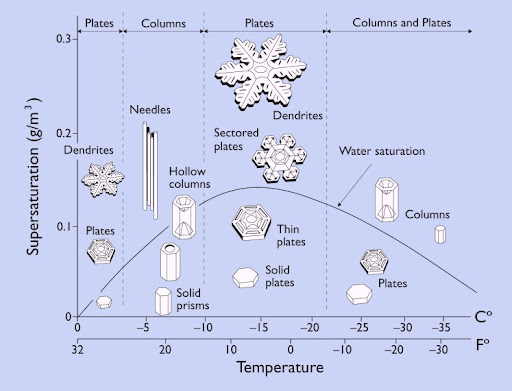
La temperatura es el factor más importante. Hay rangos de temperatura en que unas estructuras tienden a formarse más que otras (placas, columnas,...). Una humedad baja tiende a crear formas simples mientras que con una humedad alta aparecen cristales cada vez más complicados.
De este modo, que un cristal sea más bello o más elaborado no significa que el agua del que proviene sea de más calidad ni más sana, y mucho menos que su estructura haya cambiado por el buen deseo de un observador. Lo que significa es que las condiciones en las que han crecido dichos cristales han sido diferentes. Podemos fijarnos en que casi ningún copo de nieve es igual a otro, y es así debido a que cada uno de ellos ha tenido un camino de creación diferente, aunque hayan sido diferencias minúsculas.
Aquellos que todavía sigan creyendo que se pueden ordenar las moléculas del agua por unas cuantas buenas palabras y pensamientos, pueden comprar estas tazas para beber con mensajes hermosos, o una botella de agua 'geométricamente' tratada (agua estructurada coherente, la llaman) al módico precio de 30$ el bote de menos de un cuarto de litro. Que les aproveche.





2 comentarios:
no entiendo
Anónimo, ¿qué es lo que no entiendes? :-P. Puedes expresar tu duda de forma más precisa e intentaremos responderla. Un saludo y gracias por comentar.
Publicar un comentario